Advantages
■ 高い膵島集積性: 脂質組成の検討により、従来の脂質ナノ粒子製剤(DSPC-LNP等)と比較して約3倍の膵臓移行性を達成。特に膵臓内の膵島β細胞に高集積することを確認済み。
■ 1型糖尿病治療薬への可能性: 膵島β細胞を活性化しインスリン産生能を高める薬剤の効果的なDDSが可能。
Background and Technology
膵臓は腹部深層に位置し血流ネットワークも複雑であるため、全身投与による効率的な薬物送達が極めて困難な臓器の一つである。従来の脂質ナノ粒子(LNP)技術は、その性質上、肝臓など特定の臓器に集積しやすく、膵臓への十分な薬物輸送は極めて困難であり、より効果的なDDS技術が求められている。
この課題に対し、本研究者らは、肝臓などへの非特異的な集積を抑制し、膵島β細胞へ選択的に薬物輸送が可能な膵島集積型LNP技術を開発した。不飽和脂肪酸鎖であるDOPC(1,2-ジオレオイル-sn-グリセロ-3-ホスホコリン)が中心となる脂質組成に加えて、粒子径を約150 nmに精密制御することにより、静脈投与した際に血管から膵島組織への移行と組織内での滞留を最大化できることを確認した。
本発明は、低分子化合物や核酸分子に限らず多様なモダリティの有効成分をLNP内に封入でき、さらに標的である膵島β細胞への輸送と、その位置での確実な作用発現が可能な、特に1型糖尿病の根本治療における革新的なDDSプラットフォームであると言える。
また、粒子径をさらに小さく、30 nm前後に調整することにより膵島以外の部位へ集積させることも可能なことを実験的に確認しており、これにより膵炎や膵臓がんなどの外分泌系疾患向けのDDSとしても応用が可能である。
Key Data & Next Steps
マウスモデルにおいて、非臨床POCを検証済み。具体的には、低分子(例:ノビレチン)、核酸分子(siRNA、mRNA)の膵島への送達と集積、および薬効発現を確認済み。
Key Data:
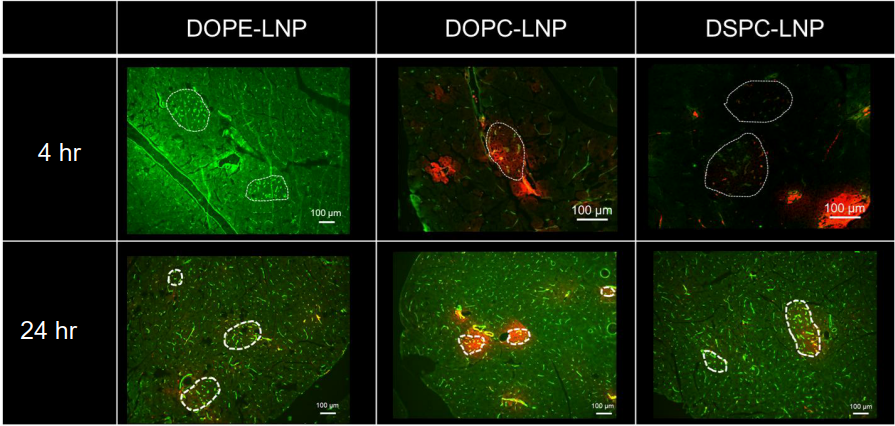
- DiD標識LNPをマウス尾静脈に投与し、24時間後の臓器分布を、ex vivo蛍光イメージングと膵組織切片観察により確認した。その結果、DOPC-LNPは膵臓に多く集積し脾臓・肝臓への分布が相対的に低くなることが確認され、さらに膵島に高集積することを確認した(下図:点線領域が膵島)。
- 膵臓β細胞の保護やインスリン分泌促進作用が知られる低分子化合物のノビレチンを封入した本発明のLNPを、糖尿病モデルマウスに対し2週間静脈投与した結果、経口投与の場合の1/10,000の薬剤量で有意な耐糖能改善効果が見られた。
- さらにイオン化脂質(MC3)を含むLNPを調製した試験により、マウス膵島において蛍光標識されたmRNAが細胞質内へ放出されることを確認、膵島β細胞特異的な発現誘導の可能性が示唆された 。
Next Steps:
膵島β細胞の増殖作用が知られる化合物や、タンパク質を発現するmRNA医薬を封入したLNPを用い、またin vivo実験を計画中(AMED採択テーマ)。
Expectations & Partnering Model
徳島大学では、ヒト糖尿病、およびヒト膵臓疾患(膵炎、膵臓がん)の治療薬を開発される製薬企業様とのコラボレーションを希望されています。また他に、各種脂質原薬を保有の企業様、研究用試薬企業様との共同研究も歓迎しています。研究者との直接の面談に加えて、徳島大学とのNDA締結等による未公開データの開示も可能です。ご希望がございましたらお気軽にお問い合わせください。
Principal Investigator
金沢 貴憲 教授
(徳島大学 大学院医歯薬学研究部 薬物治療学分野)
Patents and Publications
Patents:
- PCT/JP2024/019985(WO2024/253032として国際公開)
Publications:
- Oguma T, et al., J. Control. Release (2024) 373, 917–928.
[DOI] https://doi.org/10.1016/j.jconrel.2024.07.059